APG-2575关键注册II期临床完成首例患者给药,亚盛医药-B(06855)细胞凋亡临床开发全面提速
在实现首款产品奥雷巴替尼(商品名:耐立克®)顺利获批上市后,今年以来,亚盛医药-B(06855)再次在细胞凋亡管线创新研发和新药落地的关键进度上实现了质的飞跃。随着细胞凋亡管线全球化临床开发的稳步高效推进,APG-2575临床试验又取得关键进展,预示着亚盛医药重磅细胞凋亡产品距离落地上市又进了一步。
3月15日,亚盛医药宣布,公司在研原创1类新药Bcl-2选择性抑制剂APG-2575治疗复发/难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(R/R CLL/SLL)的中国关键注册II期临床试验(APG2575CC201)已完成首例患者给药,是全球第2个进入注册临床阶段的Bcl-2抑制剂。
APG2575CC201是一项在R/R CLL/SLL患者中进行的单臂、开放性关键注册II期临床研究,用于评估 APG-2575的有效性和安全性。该研究的主要终点指标为总缓解率(ORR)。基于APG-2575目前已获得的安全性、有效性数据,国家药品监督管理局药物审评中心(CDE)已同意APG2575CC201的研究结果将支持未来适应症R/R CLL/SLL的上市申请。
CLL/SLL是一种成熟B淋巴细胞克隆增殖性肿瘤,是西方国家发病率最高的淋巴肿瘤之一。在北美和欧洲,该疾病约占所有白血病的 30%。美国监测、流行病学及预后(SEER)计划报告显示,2021年美国新增21,250例CLL患者,同时发生4,320例相关死亡。在中国,2020年报告的新增CLL病例为15,167例。但目前随着中国进入老龄化社会,以及生活和饮食方式的改变,预计中国CLL/SLL发病率将呈增多趋势,且具有发病年龄低、侵袭度高等特点。
尽管免疫化疗及BTK抑制剂等一线方案明显提高了CLL/SLL患者初治缓解率,但是复发和耐药还是临床难题。对于复发难治性CLL/SLL患者而言,疾病进展快速,治疗效果欠佳,所以急需针对CLL/SLL开展更多的临床研究,以寻找有效的新型治疗手段。
APG-2575是亚盛医药在研的新型口服Bcl-2选择性小分子抑制剂,通过选择性抑制Bcl-2蛋白来恢复肿瘤细胞程序性死亡机制(细胞凋亡),从而诱导肿瘤细胞凋亡,达到治疗肿瘤的目的。APG-2575是首个在中国进入临床阶段的、本土研发的Bcl-2选择性抑制剂,也是全球第2个进入注册临床阶段的Bcl-2抑制剂。APG-2575目前已在中国、美国、澳大利亚、欧洲等全球多地开展包括CLL/SLL在内的多种血液肿瘤和实体瘤的临床研究。
从适应症市场层面来看,2016年Bcl-2靶点的首个抑制剂Venetoclax在上市后市场表现较佳,在证明该靶点的可成药性的同时,还为这一赛道打通了变现通路。而这也就意味着,APG-2575的未来市场空间同样广阔。
据智通财经APP了解,在Venetoclax适应症范围扩大以及新药上市的推动下,细胞凋亡标靶治疗的全球市场规模从2018年的3亿美元预计增长至2023年的49亿美元,到2030年进而增至220亿美元。相应地预计到2030年,全球范围内的CLL药品销售峰值也将超过100亿美元。
在此市场背景下,作为艾伯维的Venetoclax在全球范围内唯一可与之竞争的同靶点药物,APG-2575在全球快速推进临床研究,并在去年的美国ASCO年会、ASH年会上 先后发布该品种在CLL适应症方面的临床进展,呈现较大的best-in-class潜力。
亚盛医药首席医学官翟一帆博士表示:“针对复发/难治性CLL/SLL患者的治疗是目前全球尚未满足的临床需求。APG-2575是公司细胞凋亡产品管线的重要临床开发品种,在前期研究中展现出良好的安全性和有效性数据,并具有成为‘同类最佳’的潜力。完成关键II期临床的首例患者入组之后,我们将继续积极推进APG-2575的临床开发,为中国乃至全球CLL/SLL患者带来新的治疗选择,让更多无药可医的CLL/SLL患者尽早获益。”
您可能也感兴趣:
为您推荐
宝鹰股份副总经理金红英辞职 张东辉接任
扩大交通运输有效投资助力经济“开局稳”
发改委:提高养老托育的有效供给是今年发展的重点任务
更多
- 永达汽车(03669)2021年度股东应占净利同比增长52.6%至24.80亿...
- 中信国际电讯(01883)2021年度股东应占溢利同比上升5.2%至10.7...
- 扭亏为盈 金辉集团(00137)2021年度股东应占溢利净额为8.27亿...
- 港灯-SS(02638)2021年度纯利同比增长7.4%至29.33亿港元 拟派...
- 宏利金融-S(00945):7.5亿美元优先票据的公开发行定价为100厘
- 港股异动 | 金蝶国际(00268)拉升7% 云业务需求持续向好,...
- 小摩全线下调中国互联网板块评级 仅快手(01024)获“增持”评级
- 瑞银:普拉达(01913)去年下半年表现胜预期 预计股价反应正面
排行
精彩推送
- APG-2575关键注册II期临床完成首例患者给药,亚盛医药-B(0685...
- 澳洲成峰高教(01752):徐榕宁获任执行董事兼首席执行官
- 永达汽车(03669)2021年度股东应占净利同比增长52.6%至24.80亿...
- 中信国际电讯(01883)2021年度股东应占溢利同比上升5.2%至10.7...
- 宏利金融-S(00945):7.5亿美元优先票据的公开发行定价为100厘
- 中信国际电讯(01883)2021年度股东应占溢利同比上升5.2%至10.7...
- 港灯-SS(02638)2021年度纯利同比增长7.4%至29.33亿港元 拟派...
- 港股午评:恒指跌3%失守19000点 科技股继续大跌
- 扭亏为盈 金辉集团(00137)2021年度股东应占溢利净额为8.27亿...
- 港灯-SS(02638)2021年度纯利同比增长7.4%至29.33亿港元 拟派...
- 宏利金融-S(00945):7.5亿美元优先票据的公开发行定价为100厘
- 港股异动 | 泡泡玛特(09992)反弹8% 前两月潮玩销售额增长...
- 港股异动 | 金蝶国际(00268)拉升7% 云业务需求持续向好,...
- 小摩全线下调中国互联网板块评级 仅快手(01024)获“增持”评级
- 2022虎年本色金银币价格(2022年03月15日)
- 2022年30克熊猫金币价格(2022年03月15日)
- 2022壬寅年1公斤金制纪念币价格(2022年03月15日)
- 2022虎年彩色金银币价格(2022年03月15日)
- 瑞银:普拉达(01913)去年下半年表现胜预期 预计股价反应正面
- 崩跌的全球股市还有救?小摩:养老基金再平衡或带来10%的反弹
- 港股异动 | 金蝶国际(00268)拉升7% 云业务需求持续向好,...
- 港股异动 | 长城汽车(02333)反弹逾10% 3月博世ESP短缺有望...
- 港股异动 | 长城汽车(02333)反弹逾10% 3月博世ESP短缺有望...
- 2022年熊猫金套币价格今天多少一克(2022年03月15日)
- 银科控股首席经济学家夏春:每一次股市大跌,最深层的逻辑都...
- 瑞银:维持统一企业中国(00220)“买入”评级 目标价12.5港元
- 小摩全线下调中国互联网板块评级 仅快手(01024)获“增持”评级
- 瑞银:普拉达(01913)去年下半年表现胜预期 预计股价反应正面
- 港股异动︱基石药业-B(02616)涨超4% 普吉华®扩展适应症获批...
- 北京菜百黄金价格今天多少一克(2022年03月15日)
- 大摩:予高鑫零售(06808)“与大市同步”评级 目标价3.9港元
- 上海老庙黄金价格今天多少一克(2022年03月15日)
- 港股异动︱华兴资本控股(01911)涨近4% 预期年度利润稳增约56.5%
- 北京菜百铂金多少钱一克(2022年03月15日)参考价格
- 上海老庙铂金多少钱一克(2022年03月15日)参考价格
- 上海老凤祥铂金多少钱一克(2022年03月15日)参考价格
- 港股异动︱希玛眼科(03309)涨近2%振幅超8% 预期年度股东应占...
- 国金证券:10亿元短期融资券发行完毕 票面利率2.75%
- 申万宏源香港:维持物业管理板块“看好”评级 优质房企有望...
- 港股异动︱众安在线(06060)盘中反弹超11% 前两个月原保险保...
- 港股异动︱众安在线(06060)盘中反弹超11% 前两个月原保险保...
- 港股异动 | 美团-W(03690)大涨7% 社零数据优于预期,机构...
- 港股异动 | 赣锋锂业(01772)早盘反弹近5% 首2月纯利同比增...
- 银行业混战绿色金融 价格战隐忧浮现
- 申万宏源香港:维持物业管理板块“看好”评级 优质房企有望...
- *ST腾邦:控股股东腾邦集团被动减持公司股份665万股
- 1.25亿元!华测检测拟回购股份用于后期实施股权激励计划
- 精测电子:实控人质押100万股用于补充质押
- 黄金价格高位回落 静待俄乌冲突风险缓和
- 吉峰科技:控股股东王新明质押500万股用于公司融资
- 港股异动 | 物管股继续重挫 旭辉永升服务(01995)跌超11% ...
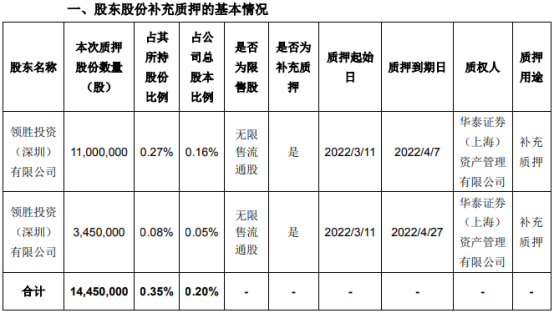
- 领益智造:控股股东质押1445万股用于补充质押
- 大摩:予高鑫零售(06808)“与大市同步”评级 目标价3.9港元
- 俄乌第四轮谈判暂停黄金震荡下跌
- 宝鹰股份副总经理金红英辞职 张东辉接任
- 国信证券:维持友邦保险(01299)“买入”评级 目标价降至115港元
- 港股异动︱俊知集团(01300)高开逾4% 预计2021年业绩扭亏为盈至2亿元
- 扩大交通运输有效投资助力经济“开局稳”
- 港股异动 | 物管股继续重挫 旭辉永升服务(01995)跌超11% ...
- 泰顺县城镇发展公司底价竞得1宗商住地 出让面积23487平方米
- 今日俄乌第四次谈判贵金属低开行情
- 总建面8.9万㎡!市南区南京路1号地块规划调整
- 俄乌第四轮谈判暂停 黄金价格短线下行
- 港股异动 | 昆仑能源(00135)重挫14%领跌石油股 俄乌有望签...
- 浙江新湖集团:控股股东解除质押新湖中宝1.77%
- 港股异动︱中烟香港(06055)涨超4% 2021年股东应占利润同比增...
- 突发!蚌埠高新区1宗居住用地暂停出让
- 避险降温黄金回落静待本周加息会议
- 港股异动︱中烟香港(06055)涨超4% 2021年股东应占利润同比增...
- 港股异动 | 恒生科技指数低开逾5% 阿里巴巴-SW(09988)、腾...
- 国信证券:维持友邦保险(01299)“买入”评级 目标价降至115港元
- 港股异动︱俊知集团(01300)高开逾4% 预计2021年业绩扭亏为盈至2亿元
- 北控清洁能源集团(01250)拟向山高金融(00412)配发约488.04亿...
- ITP HOLDINGS(08446)获马烈收购55%股份并折让91.97%提现金要约 3月15日复牌
- 智通港股通占比异动统计|3月15日
- 青山深夜发布重磅声明 LME紧随其后宣布恢复交易
- 发改委:提高养老托育的有效供给是今年发展的重点任务
- 以更大力度、更有效举措持续助力企业纾困发展
- 棠记控股(08305)预计2021年度综合亏损不少于3000万港元
- 真金白银“托底”!A股再现回购浪 机构称龙头公司真不贵
- 中概股集体危机如何破局?投行、律师、基金管理人见仁见智
- 凤凰卫视(02008):凤凰新媒体2021年度持续经营净亏损为2.057亿元
- 棠记控股(08305)预计2021年度综合亏损不少于3000万港元
- 山高金融(00412)拟认购488.04亿股北控清洁能源(01250)股份 3月15日复牌
- 智通港股股东权益披露|3月15日
- 智通港股通占比异动统计|3月15日
- 智通港股沽空统计|3月15日
- 汇丰控股(00005)3月14日回购约110.26万股
- 收益何时回暖?1600余只银行理财产品“破净”,占比超5%
- 买不了、卖不出、撤不了?招商证券交易系统“崩了”!投资者...
- 智通港股通资金流向统计(T+2)|3月15日
- 圣诺医药-B(02257)将在美国波士顿OPT会议上公布其GalNAc-肝脏...
- 圣诺医药-B(02257)将在美国波士顿OPT会议上公布其GalNAc-肝脏...
- 避险资金出逃500亿之时,国际大行喊出“超配中国”
- 中国生物制药(01177):“盐酸考来维仑片”获美国仿制药申请批准
- 中金公司(03908)附属拟发行6亿美元票据
- 亚盛医药-B(06855):Bcl-2选择性抑制剂APG-2575中国关键注册I...
- 华润医药(03320):江中药业(600750.SH)预计一季度归母净利同...
- 智通港股通资金流向统计(T+2)|3月15日
- 汇丰控股(00005)3月14日回购约110.26万股







 营业执照公示信息
营业执照公示信息